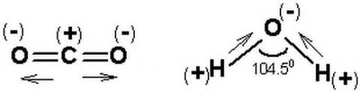Basit ve molekül formülleri hakkında örnek sorular nelerdir?
Kimyasal bileşiklerin yapı taşlarını anlamak için basit ve molekül formüllerinin nasıl hesaplandığını gösteren örnekler, bu kavramların pratikte nasıl uygulandığını net bir şekilde ortaya koyuyor.
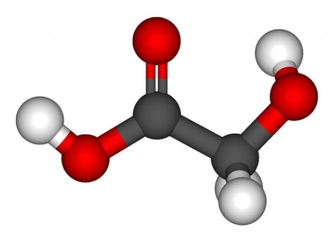
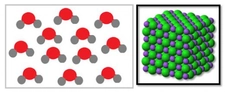
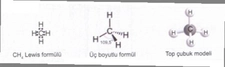
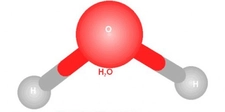
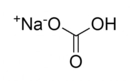
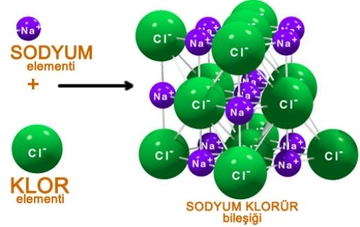
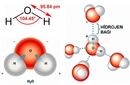
Basit ve Molekül Formülleri Hakkında Örnek Sorular Basit formül (ampirik formül), bir bileşiğin elementlerinin en basit tam sayı oranını gösterirken, molekül formülü bileşiğin gerçek atom sayılarını yansıtır. Aşağıda bu konuları pekiştirmek için örnek sorular ve çözümleri bulunmaktadır. 1. Basit Formül Hesaplama Sorusu Soru: Bir bileşiğin kütlece %40'ı karbon (C), %6,67'si hidrojen (H) ve %53,33'ü oksijendir (O). Bu bileşiğin basit formülünü bulunuz. Çözüm:
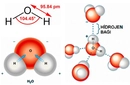
2. Molekül Formülü Hesaplama Sorusu Soru: Bir bileşiğin basit formülü CH2O'dur ve molekül kütlesi 180 g/mol'dür. Bu bileşiğin molekül formülünü bulunuz. Çözüm:
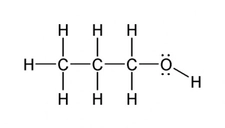
3. Karmaşık Bileşik Sorusu Soru: 4,6 g organik bileşik yakıldığında 8,8 g CO2ve 5,4 g H2O oluşuyor. Bileşiğin molekül kütlesi 46 g/mol ise, basit ve molekül formüllerini bulunuz. Çözüm:
4. Yüzde Bileşim Sorusu Soru: Bir bileşiğin kütlece %92,3'ü karbon ve %7,7'si hidrojendir. Molekül kütlesi 78 g/mol ise, molekül formülünü belirleyiniz. Çözüm:
5. Gaz Halindeki Bileşik Sorusu Soru: 0,1 mol gaz halindeki bir bileşiğin kütlesi 4,4 g'dır. Element analizi sonucu bileşiğin kütlece %27,3'ü karbon ve %72,7'si oksijen olduğu bulunmuştur. Bileşiğin molekül formülünü bulunuz. Çözüm:
Bu sorular, basit ve molekül formüllerini anlamak ve hesaplamak için temel alıştırmalar sağlar. Pratik yaparak, kütle yüzdeleri, mol hesaplamaları ve oranlarla formül belirleme becerilerinizi geliştirebilirsiniz. |