
Moleküller Arası Bağlar Nelerdir?
Moleküller arası bağlar, moleküllerin birbirleriyle etkileşimlerini ve bu etkileşimlerin özelliklerini belirleyen kimyasal bağlardır. İyonik, kovalent ve Van der Waals kuvvetleri gibi çeşitleri, maddelerin fiziksel ve kimyasal özelliklerinin şekillenmesinde kritik rol oynar.
Moleküller arası bağlar, moleküller arasındaki etkileşimleri ve bu etkileşimlerin özelliklerini tanımlayan önemli kimyasal bağlardır. Bu bağlar, moleküllerin fiziksel ve kimyasal özelliklerini belirlemede kritik bir rol oynamaktadır. Genel olarak, moleküller arası bağlar, moleküllerin birbirleriyle nasıl etkileşime girdiğini ve bu etkileşimlerin sonucunda oluşan yapıların özelliklerini belirler. Aşağıda, moleküller arası bağların türleri ve özellikleri detaylı bir şekilde incelenecektir. Moleküller Arası Bağların Türleri Moleküller arası bağlar, çeşitli türlerde sınıflandırılabilir. Bu bağlar, genellikle üç ana grupta incelenmektedir:
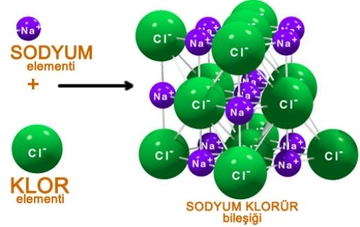
İyonik Bağlar İyonik bağlar, bir atomun elektronları diğer bir atoma transfer ettiğinde oluşan bağlardır. Bu bağlar, pozitif ve negatif yüklü iyonlar arasında meydana gelir. İyonik bağların özellikleri şunlardır:
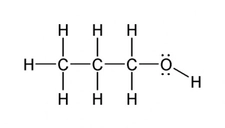
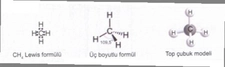
Kovalent Bağlar Kovalent bağlar, iki atomun elektronları paylaşarak oluşturduğu bağlardır. Bu bağlar, genellikle nonmetaller arasında meydana gelir. Kovalent bağların özellikleri şunlardır:
Van der Waals Kuvvetleri Van der Waals kuvvetleri, moleküller arasında zayıf etkileşimlerdir. Bu kuvvetler, moleküllerin geçici dipol oluşumu veya kalıcı dipollerden kaynaklanabilir. Van der Waals kuvvetlerinin özellikleri şunlardır:
Moleküller Arası Bağların Önemi Moleküller arası bağlar, birçok kimyasal ve fiziksel olayda kritik bir rol oynamaktadır. Bu bağların önemi aşağıda sıralanmıştır:
Sonuç Moleküller arası bağlar, kimyasal bağların önemli bir parçasını oluşturur ve birçok fiziksel ve kimyasal süreçte kritik bir role sahiptir. İyonik, kovalent ve Van der Waals kuvvetleri, moleküllerin birbirleriyle etkileşimlerini belirler ve bu etkileşimler, madde özelliklerini şekillendirir. Moleküller arası bağların anlaşılması, kimya ve biyoloji gibi birçok bilim dalında temel bir kavramdır ve bu bağların özellikleri, materyal bilimi, biyokimya ve ilaç tasarımı gibi alanlarda önemli uygulamalara sahiptir. |
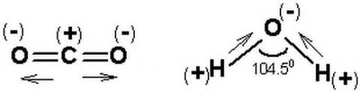









Moleküler etkileşimler, kimyasal ve fiziksel olayların temelini oluşturuyor. Moleküller arasındaki bağlar, madde özelliklerini belirlemede kritik bir rol oynuyor. Özellikle iyonik, kovalent ve Van der Waals kuvvetleri, bu etkileşimlerin çeşitliliğini ve önemini gösteriyor. Moleküller arasındaki bağlar, kimyanın ve biyolojinin temel taşlarıdır.
Moleküler Etkileşimlerin Önemi
Kesinlikle katılıyorum, moleküler etkileşimler kimyanın ve biyolojinin temel taşlarını oluşturuyor. İyonik, kovalent ve Van der Waals kuvvetleri gibi farklı etkileşim türleri, maddelerin fiziksel ve kimyasal özelliklerini belirlemede kritik bir rol oynuyor. Bu bağların gücü ve doğası, maddelerin nasıl davrandığını, birbirleriyle nasıl etkileşime girdiğini ve dolayısıyla hayatın temel süreçlerini nasıl şekillendirdiğini anlamamızda bize yardımcı oluyor.
Moleküler Bağların Çeşitliliği
Özellikle biyolojik sistemlerde moleküller arasındaki etkileşimlerin çeşitliliği, yaşamın karmaşıklığını anlamak açısından büyük bir önem taşıyor. Örneğin, proteinlerin üç boyutlu yapısı ve işlevi, bu tür etkileşimlerin niteliğine bağlıdır. Aynı şekilde, hücre zarının yapısı ve işlevi de moleküller arası etkileşimlerle doğrudan ilişkilidir.
Sonuç
Sonuç olarak, moleküler etkileşimler, bilimsel araştırmalarda ve uygulamalarda dikkatle incelenmesi gereken bir alan. Bu etkileşimlerin anlaşılması, yeni tedavi yöntemleri geliştirmekten, malzeme bilimine kadar birçok alanda ilerlemeler sağlamaktadır.
Moleküler arası çekim kuvvetlerinin gaz, katı ve sıvı hallerindeki etkisi hayatımızda çok önemli. Gaz halinde moleküller arasındaki bağlar zayıfken, katı ve sıvıda bu kuvvetler daha belirgin hale geliyor. Bu durum, maddelerin fiziksel özelliklerini de etkiliyor.
Merhaba Elif,
Yorumunuzda moleküller arasındaki çekim kuvvetlerinin gaz, katı ve sıvı hallerindeki etkisini çok güzel özetlemişsiniz. Gerçekten de bu kuvvetlerin zayıf veya güçlü olması, maddelerin fiziksel özelliklerini doğrudan etkiliyor.
Gaz Halindeki Moleküller
Gaz halinde moleküller arasındaki zayıf bağlar, gazların genişleyebilme ve şekil alabilme özelliklerini sağlıyor. Bu durum, gazların hareketliliğini artırırken, basınç ve sıcaklık gibi faktörlerden etkilenmelerini de kolaylaştırıyor.
Katı ve Sıvı Hallerindeki Etkiler
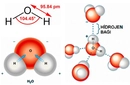
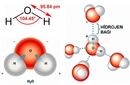
Katı ve sıvı hallerinde ise moleküller arasındaki çekim kuvvetleri daha belirgin hale geliyor. Bu kuvvetler, maddelerin sertliği, akışkanlığı ve hatta erime ile kaynama noktalarını etkiliyor. Örneğin, suyun sıvı halindeki özellikleri, hidrojen bağlarının varlığı sayesinde birçok maddeye göre daha yüksektir.
Bu tür bilimsel gerçeklerin hayatımızdaki yeri son derece önemli. Gündelik yaşamda karşılaştığımız pek çok olayı, bu temel prensiplerle açıklamak mümkün. Teşekkürler, bu konudaki düşüncelerinizi paylaştığınız için!
Dipol dipol etkileşimi nedir, merak ediyorum. Polar moleküller arasındaki bu etkileşimin nasıl oluştuğunu ve hangi örneklerde görüldüğünü öğrenmek istiyorum. Ayrıca bu etkileşimin moleküller arasındaki bağların güçlenmesine etkisi hakkında bilgi verirseniz çok sevinirim.
Dipol Dipol Etkileşimi Nedir?
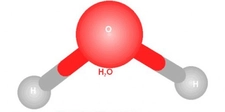
Dipol dipol etkileşimi, polar moleküller arasında meydana gelen bir etkileşim türüdür. Polar moleküller, molekül içerisindeki atomların elektronegatiflik farklılıkları nedeniyle, pozitif ve negatif uçlar (dipoller) oluştururlar. Bu dipollerin birbirini çekmesi, dipol dipol etkileşimini yaratır.
Nasıl Oluşur?
Dipol dipol etkileşimi, polar moleküllerin pozitif ve negatif uçlarının birbirine yaklaşmasıyla gerçekleşir. Moleküller arasındaki bu etkileşim, moleküllerin birbirini çekmesini sağlar ve genellikle sıvı veya katı halindeki maddelerin fiziksel özelliklerini etkiler.
Hangi Örneklerde Görülür?
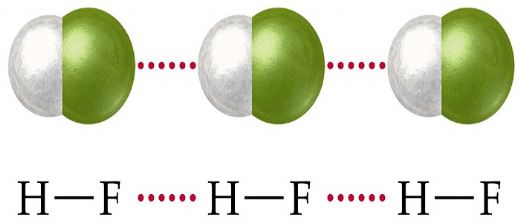
Dipol dipol etkileşimini su (H₂O), amonyak (NH₃) ve hidroklorik asit (HCl) gibi polar moleküllerde görebiliriz. Bu maddelerin fiziksel özellikleri, dipol dipol etkileşimlerinin varlığından etkilenir ve bu etkileşim, bu maddelerin kaynama noktası ve erime noktası gibi özelliklerini belirler.
Moleküller Arasındaki Bağların Güçlenmesine Etkisi
Dipol dipol etkileşimleri, moleküller arasındaki bağları güçlendirebilir. Bu etkileşimler, moleküllerin düzenli bir yapıda bir arada durmasına yardımcı olur. Örneğin, su molekülleri arasındaki dipol dipol etkileşimleri, suyun yüksek yüzey gerilimi ve yüksek kaynama noktasına sahip olmasına katkıda bulunur. Bu nedenle, dipol dipol etkileşimleri, birçok kimyasal ve fiziksel süreçte önemli bir rol oynar.
Maddenin gaz halinde moleküller neden birbirinden bu kadar uzakta hareket ederken, katı ve sıvı hallerinde bu kadar yakın ve bağlı hareket ediyorlar? Moleküller arası mesafenin ve itme-çekme kuvvetlerinin bu kadar farklı olmasının nedeni nedir?
Recai,
Maddenin farklı halleri arasındaki moleküler hareket ve mesafe farklılığı, moleküler arası kuvvetlerin ve enerjinin etkisiyle açıklanabilir. Gaz halinde moleküller, daha yüksek enerjiye sahip oldukları için birbirlerinden uzak ve serbest bir şekilde hareket ederler. Bu yüksek enerji, moleküller arasındaki itme ve çekme kuvvetlerini aşarak, moleküllerin birbirinden bağımsız hareket etmesini sağlar.
Katı ve sıvı hallerinde ise moleküller daha düşük enerjiye sahiptir ve aralarındaki çekim kuvvetleri daha belirgindir. Katı hâlde moleküller düzenli bir yapıda ve sabit pozisyonlarda bulunurlar, bu da moleküllerin birbirine çok yakın olmasına neden olur. Sıvı hâlde ise moleküller, katıya göre daha hareketli olsalar da yine de birbirlerine yakındırlar ve aralarında belirli bir çekim kuvveti vardır.
Bu farklılıklar, moleküllerin sahip olduğu enerji seviyeleri ve moleküler arası kuvvetlerin etkisiyle açıklanabilir.