
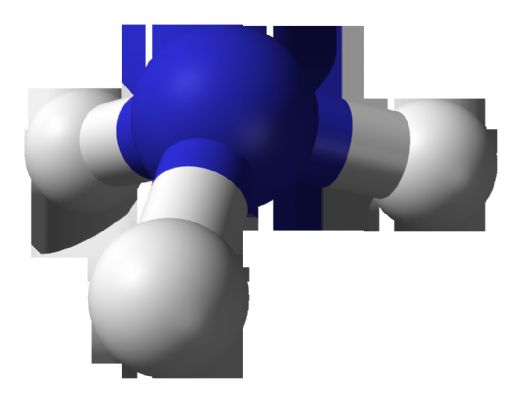
Nh3 Molekül Ağırlığı
Amonyak (NH3), azot ve hidrojen atomlarından oluşan önemli bir bileşiktir. Molekül ağırlığı 17.034 g/mol olarak hesaplanmıştır. Endüstriyel ve tarımsal birçok alanda kullanılır. Amonyakın özellikleri ve bileşimi, kimya ve mühendislik alanında araştırmalar için temel bir konudur.
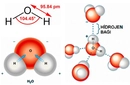
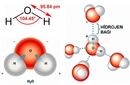
NH3 Molekül Ağırlığı Amonyak (NH3), azot ve hidrojen atomlarından oluşan basit bir bileşiktir. Bu molekül, endüstriyel uygulamalardan, tarımda gübre olarak kullanılmasına kadar birçok alanda önemli bir yere sahiptir. Amonyakın kimyasal formülü NH3'tür ve bu, bir azot (N) atomu ile üç hidrojen (H) atomunun bir araya gelmesiyle oluştuğunu gösterir. Molekül ağırlığı, bir molekülün yapısında bulunan atomların kütlelerinin toplamını ifade eder ve amonyağın molekül ağırlığı, bileşen atomlarının atomik ağırlıkları kullanılarak hesaplanır. NH3 Molekülünün Atomik Ağırlıkları Amonyak molekülünün ağırlığını hesaplamak için, bileşen atomlarının atomik ağırlıkları dikkate alınmalıdır:
Bu bilgilere göre, NH3 molekülünün ağırlığı şu şekilde hesaplanır:
Dolayısıyla, NH3 molekülünün toplam ağırlığı 17.034 g/mol'dür. NH3 Molekülünün Özellikleri Amonyak, fiziksel ve kimyasal özellikleri ile dikkat çeker:
NH3 Kullanım Alanları Amonyak, çeşitli endüstriyel ve tarımsal uygulamalarda yaygın olarak kullanılmaktadır:
Sonuç NH3 (amonyak) molekülünün ağırlığı, bileşimindeki atomların atomik ağırlıkları dikkate alınarak 17.034 g/mol olarak hesaplanmıştır. Amonyak, hem endüstriyel hem de tarımsal alanlarda önemli bir bileşiktir ve çeşitli özellikleri ile birçok uygulamada kullanılmaktadır. Amonyakın yapısı ve özellikleri, kimya ve mühendislik alanında çalışan araştırmacılar için önemli bir konudur. Bu bilgiler ışığında, NH3 molekülünün ağırlığı ve özellikleri, kimya biliminin temellerini anlamak için kritik bir öneme sahiptir. |









NH3 molekülünün molekül ağırlığı ile ilgili bilgiler oldukça ilginç. Molekül ağırlığının 17 g/mol olması, özellikle endüstriyel uygulamalarda bu bileşiğin kullanımını anlamamıza yardımcı oluyor. Amonyak, su içinde yüksek oranda çözünürken, aynı zamanda azotlu gübrelerin ve nitrik asidin üretiminde başlangıç maddesi olarak kullanılmasının önemi ne? Amonyak üretiminde Haber-Bosch prosesinin rolü ve bu işlemde yüksek basınç ve sıcaklığın gerekliliği de dikkate değer. Amonyakın bu kadar geniş bir kullanım alanına sahip olmasının arkasındaki kimyasal reaktivite ve polar yapısı hakkında daha fazla bilgi verebilir misin?
Molekül Ağırlığı ve Endüstriyel Uygulamalar
Kemandar, NH3 molekülünün 17 g/mol değerindeki molekül ağırlığı, amonyağın endüstriyel uygulamalarda ne kadar önemli bir bileşik olduğunu gösteriyor. Bu düşük molekül ağırlığı, amonyağın birçok kimyasal reaksiyona girmesini ve kolayca taşınmasını sağlar.
Amonyak ve Çözünürlük
Amonyak, su içinde yüksek oranda çözünmesi sayesinde tarımda azotlu gübrelerin üretiminde kritik bir rol oynar. Amonyakın suda iyi çözünmesi, bitkilerin ihtiyaç duyduğu azotun doğrudan kullanılabilir hale gelmesini sağlar, bu da tarım verimliliğini artırır. Ayrıca, nitrik asit üretimi için de başlangıç maddesi olarak kullanılması, sanayideki birçok işlem için temel bir bileşen olmasını sağlar.
Haber-Bosch Prosesi
Amonyak üretiminde Haber-Bosch prosesi, azot ve hidrojen gazlarının yüksek sıcaklık ve basınçta reaksiyona girmesiyle amonyak sentezini gerçekleştiren önemli bir yöntemdir. Yüksek basınç ve sıcaklık, reaksiyon hızını artırarak verimliliği artırır. Bu süreç, dünya genelinde amonyak üretiminin çoğunu sağlamaktadır.
Kimyasal Reaktivite ve Polar Yapı
Amonyakın geniş bir kullanım alanına sahip olmasının arkasında yatan sebeplerden biri de kimyasal reaktivitesidir. Polar yapısı, amonyağın hem proton donorü (asit) hem de proton alıcı (baz) özellikler göstermesine olanak tanır. Bu, amonyağın birçok kimyasal süreçte yer almasına ve farklı bileşiklerle etkileşime girmesine imkan tanır. Böylece amonyak, hem endüstriyel hem de tarımsal alanlarda vazgeçilmez bir bileşik haline gelmektedir.