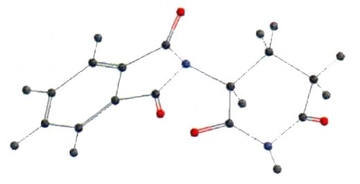
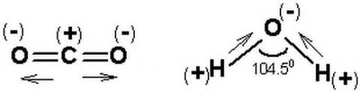Su molekül geometrisi nedir ve nasıl oluşur?
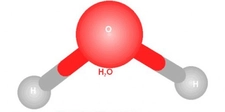
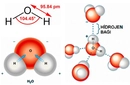
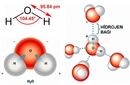
Su molekülünün kavisli yapısı, oksijen atomunun etrafındaki elektron dağılımı ve bağ açılarının etkileşimiyle şekillenir. Bu geometrik düzen, suyun yüksek yüzey gerilimi ve sıra dışı termal özellikleri gibi davranışlarının arkasındaki bilimsel temeli oluşturur. Molekülün 104.5 derecelik açısı, hem kimyasal bağların doğasını hem de maddenin gündelik özelliklerini anlamak için önemli ipuçları sunar.
Su Molekülünün Geometrisi Su molekülünün geometrisi, kavisli (bent veya açısal) moleküler geometri olarak adlandırılır. Bu geometri, su molekülünün (H₂O) merkezindeki oksijen atomunun etrafında iki hidrojen atomunun belirli bir açıyla bağlanması sonucu oluşur. Su molekülünde, oksijen ve hidrojen atomları arasındaki bağ açısı yaklaşık 104.5 derece dir. Bu yapı, suyun birçok benzersiz özelliğinin (yüksek yüzey gerilimi, yüksek kaynama noktası gibi) temelini oluşturur. Su Molekül Geometrisinin Nasıl Oluştuğu Su molekülünün kavisli geometrisi, aşağıdaki faktörlerin birleşimiyle açıklanabilir:
Sonuç olarak, su molekülünün kavisli geometrisi, oksijen atomunun hibritleşmesi ve elektron çiftleri arasındaki itme kuvvetlerinin bir ürünüdür, bu da suyun canlılar ve çevre için hayati öneme sahip özelliklerini ortaya çıkarır. |