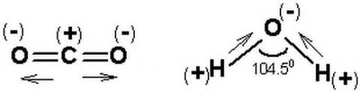Polar ve apolar moleküllerin temel farkları nelerdir?
Polar ve apolar moleküllerin tanımı, özellikleri ve aralarındaki farklar, kimyasal etkileşimlerin ve çözünürlüklerin anlaşılmasında kritik öneme sahiptir. Bu kavramlar, biyoloji ve malzeme bilimi gibi birçok alanda uygulama bulur. Moleküllerin davranışları, çeşitli bilimsel araştırmaların temelini oluşturur.
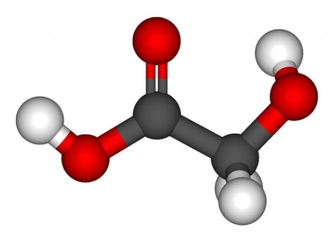
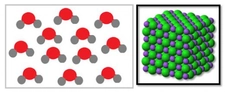
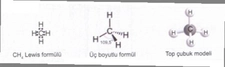
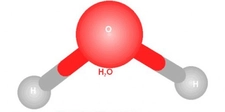
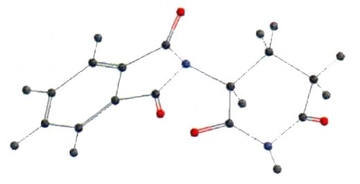
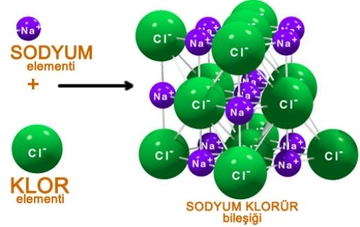
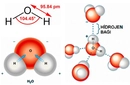
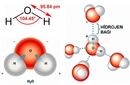
Polar ve Apolar Moleküllerin Tanımı Moleküller, atomların bir araya gelerek oluşturduğu yapılar olup, kimyasal bağlar aracılığıyla birbirlerine bağlanır. Moleküllerin polar veya apolar olarak sınıflandırılması, onların elektrik yüklerinin dağılımına bağlıdır. Polar moleküller, pozitif ve negatif yüklerin dengesiz dağılımına sahipken, apolar moleküller bu tür bir dengesizlik göstermez. Bu ayrım, moleküllerin fiziksel ve kimyasal özelliklerini etkileyen önemli bir faktördür. Polar Moleküllerin Özellikleri Polar moleküllerin temel özellikleri aşağıdaki gibidir:
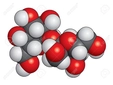
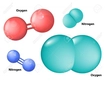
Apolar Moleküllerin Özellikleri Apolar moleküllerin temel özellikleri ise şunlardır:
Polar ve Apolar Moleküller Arasındaki Farklar Polar ve apolar moleküller arasındaki temel farklar aşağıdaki gibi sıralanabilir:
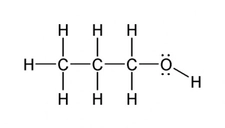
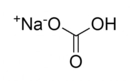
Örnekler Polar ve apolar moleküllere örnekler vermek, bu kavramları daha iyi anlamamıza yardımcı olur:
Sonuç Polar ve apolar moleküller arasındaki temel farklar, bu moleküllerin kimyasal ve fiziksel özelliklerini belirleyen önemli unsurlardır. Bu farklar, özellikle biyoloji, kimya ve malzeme bilimi gibi alanlarda önemli uygulamalara sahiptir. Moleküllerin davranışlarını anlamak, çeşitli bilimsel araştırmalar ve endüstriyel uygulamalar için kritik öneme sahiptir. |