
Birim hacimdeki molekül sayısını hesaplamak için formül nedir?
Birim hacimdeki molekül sayısını hesaplamak, gazların özelliklerini ve davranışlarını anlamak için kritik bir süreçtir. Bu içerikte, Avogadro sayısı, ideal gaz yasası ve hesaplama yöntemleri ele alınarak, gazların molekül sayısının nasıl belirleneceği açıklanmaktadır.
Birim Hacimdeki Molekül Sayısını Hesaplamak için Formül Birim hacimdeki molekül sayısı, genellikle bir gazın yoğunluğuna ve molekül ağırlığına dayanarak hesaplanabilir. Bu hesaplama, belirli bir ortamda bulunan molekül sayısını anlamak ve gazların davranışlarını incelemek için kritik bir unsurdur. Aşağıda bu hesaplama için kullanılan temel formüller ve kavramlar ele alınacaktır. 1. Avogadro Sayısı Avogadro sayısı, bir mol gazda bulunan molekül sayısını ifade eder ve değeri yaklaşık olarak \(6.022 \times 10^{23}\) moleküldür. Bu sayı, bir mol gazın hacmini hesaplamak için temel bir referanstır. 2. Gazların Davranışi Gazların davranışini anlamak için ideal gaz yasası kullanılabilir:\[PV = nRT\]Burada:- \(P\): Gazın basıncı (Pa)- \(V\): Gazın hacmi (m³)- \(n\): Mol sayısı (mol)- \(R\): Gaz sabiti (8.314 J/(mol·K))- \(T\): Mutlak sıcaklık (K) Bu formülden mol sayısı \(n\) hesaplanabilir:\[n = \frac{PV}{RT}\] 3. Birim Hacimdeki Molekül Sayısı Birim hacimdeki molekül sayısı, genellikle şu formül ile hesaplanır:\[N = \frac{n \cdot N_A}{V}\]Burada:- \(N\): Birim hacimdeki molekül sayısı- \(n\): Mol sayısı- \(N_A\): Avogadro sayısı- \(V\): Hacim (litre veya m³) Bu formül, belirli bir hacimdeki molekül sayısını hesaplamak için kullanılabilir. 4. Örnek Hesaplama Örneğin, 1 atm basınçta ve 0°C'de (273.15 K) 22.4 litre hacmindeki bir gazın molekül sayısını hesaplayalım.- \(P = 101325 \, Pa\) (1 atm)- \(V = 22.4 \, L = 0.0224 \, m³\)- \(T = 273.15 \, K\)- \(R = 8.314 \, J/(mol·K)\) Mol sayısı:\[n = \frac{PV}{RT} = \frac{101325 \times 0.0224}{8.314 \times 273.15} \approx 1 \, mol\]Birim hacimdeki molekül sayısı:\[N = \frac{1 \cdot 6.022 \times 10^{23}}{0.0224} \approx 2.68 \times 10^{25} \, molekül/m³\] 5. Sonuç Birim hacimdeki molekül sayısı, gazların davranışlarını anlamak ve kimyasal reaksiyonları incelemek için son derece önemlidir. Yukarıdaki formüller ve hesaplama yöntemleri, bu kavramı daha iyi anlamak için kullanılabilir. Bu bilgilerin, gazların fiziksel özellikleri ve kimyasal süreçleri üzerindeki etkilerini analiz etmekte faydalı olacağına inanılır. Ekstra Bilgiler Molekül sayısı hesaplamaları, gazların özellikleri ile ilgili deneysel ve teorik çalışmaları desteklemek için önemlidir. Farklı gazlar arasındaki etkileşimler, molekül sayısı ve hacim ile doğrudan ilişkilidir. Ayrıca, atmosfer bilimleri, kimya mühendisliği ve malzeme bilimi gibi alanlarda da bu hesaplamalar yaygın olarak kullanılmaktadır. |









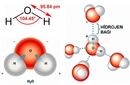
Bu hesaplamaların gazların davranışını anlamak için ne kadar önemli olduğunu düşünüyorsunuz? Özellikle moleküler sayının belirlenmesi, kimyasal reaksiyonların ve gazların fiziksel özelliklerinin incelenmesinde ne tür avantajlar sağlıyor? Örnek hesaplamada verilen değerler üzerinden, belirli bir koşuldaki moleküler yoğunluğu anlamak için hangi ek faktörlerin göz önünde bulundurulması gerektiğini düşünebilir miyiz?
Gazların Davranışını Anlamak
Temizcan, gazların davranışını anlamada hesaplamaların önemi oldukça büyüktür. Gazların fiziksel özelliklerini ve kimyasal reaksiyonlarını incelemek için moleküler sayının belirlenmesi kritik bir rol oynar. Bu hesaplamalar, gazların basınç, sıcaklık ve hacim gibi parametreler arasındaki ilişkileri ortaya koyarak, farklı koşullardaki davranışlarını anlamamıza yardımcı olur.
Moleküler Sayının Önemi
Özellikle moleküler sayıların belirlenmesi, gazların yoğunluk, molekül etkileşimleri ve reaktivite gibi özelliklerini anlamayı sağlar. Örneğin, bir gazın belirli bir sıcaklık ve basınçta ne kadar yoğun olduğunu bilmek, o gazın diğer gazlarla karışma eğilimini ve tepkimeye girme potansiyelini tahmin etmemizi kolaylaştırır. Ayrıca, bu bilgiler, endüstriyel uygulamalarda ve laboratuvar deneylerinde önemli kararlar almamıza yardımcı olur.
Ek Faktörlerin Göz Önünde Bulundurulması
Belirli bir koşuldaki moleküller yoğunluğunu anlamak için, sıcaklık, basınç ve gazın kimyasal yapısı gibi ek faktörlerin göz önünde bulundurulması gerektiğini düşünebiliriz. Örneğin, sıcaklık arttığında gaz moleküllerinin enerjisi artar ve bu da gazın hacmini etkileyebilir. Ayrıca, gazların moleküler ağırlıkları da yoğunluk üzerinde etkili bir faktördür.
Sonuç olarak, gazların davranışlarını anlamak için yapılan hesaplamalar, hem teorik hem de pratik açıdan büyük önem taşımaktadır. Bu tür hesaplamalar, gazların özelliklerini ve kimyasal reaksiyonlarını daha iyi anlamamıza yardımcı olurken, aynı zamanda çeşitli uygulamalar için de kritik veriler sunar.