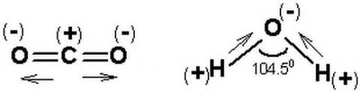Bağların Polar veya Apolar Olması ve Moleküllere Etkileri
Kimyasal bağların polar veya apolar olması, atomlar arasındaki elektron paylaşımının simetrisine ve elektronegatiflik farkına bağlıdır. Bu durum, moleküllerin fiziksel ve kimyasal özelliklerini doğrudan etkiler. Aşağıda, bağ türleri ve moleküllere olan etkileri detaylıca açıklanmıştır.
1. Apolar Bağlar
- Apolar bağlar, atomlar arasında elektronegatiflik farkının çok küçük veya sıfır olduğu durumlarda oluşur. Elektronlar eşit veya neredeyse eşit paylaşılır.
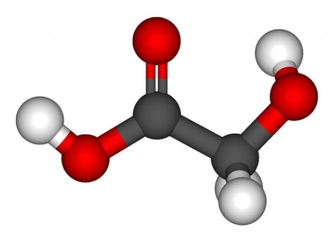
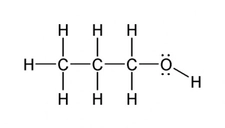
- Örnekler: Aynı atomlar arasındaki bağlar (örneğin, O₂, N₂) veya elektronegatiflikleri benzer atomlar (örneğin, C-H bağları).
- Molekül Etkisi: Apolar bağlara sahip moleküller genellikle apolar moleküllerdir. Bu moleküller suda çözünmez, düşük kaynama ve erime noktalarına sahiptir ve van der Waals kuvvetleri gibi zayıf etkileşimler gösterir.
2. Polar Bağlar
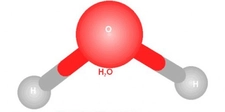
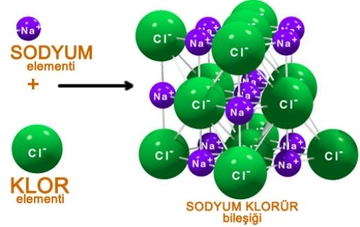
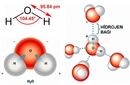
- Polar bağlar, atomlar arasında belirgin bir elektronegatiflik farkı olduğunda oluşur. Elektronlar daha elektronegatif atom tarafına çekilir, bu da kısmi pozitif ve negatif yükler oluşturur.
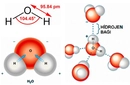
- Örnekler: H₂O (su) ve HCl gibi bileşiklerdeki bağlar.
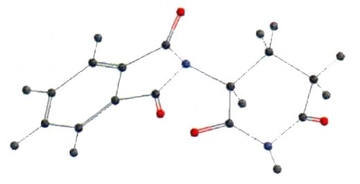
- Molekül Etkisi: Polar bağlara sahip moleküller, genellikle polar moleküllerdir (eğer molekülün geometrisi simetrik değilse). Bu moleküller suda iyi çözünür, yüksek kaynama ve erime noktalarına sahiptir ve dipol-dipol etkileşimleri veya hidrojen bağları gibi güçlü kuvvetler gösterir.
3. Moleküllerin Polar veya Apolar Olmasını Belirleyen Faktörler
- Bağ Polaritesi: Moleküldeki tüm bağların polaritesi önemlidir, ancak tek başına yeterli değildir.
- Molekül Geometrisi: Simetrik moleküller (örneğin, CO₂), polar bağlara sahip olsa da apolar olabilir, çünkü dipol momentleri birbirini sıfırlar.
- Elektronegatiflik Farkı: Atomlar arasındaki elektronegatiflik farkı ne kadar büyükse, bağ o kadar polar olur.
4. Moleküllere Etkileri
- Çözünürlük: Polar moleküller polar çözücülerde (örneğin, su), apolar moleküller apolar çözücülerde (örneğin, hekzan) iyi çözünür.
- Kaynama ve Erime Noktaları: Polar moleküller daha yüksek sıcaklıklarda kaynar ve erir, çünkü moleküller arası kuvvetler daha güçlüdür.
- Kimyasal Reaktivite: Polar bağlar, moleküllerin reaksiyonlara girme eğilimini artırabilir, özellikle iyonik veya polar bileşiklerle etkileşimde.
- İletkenlik: Suda çözündüklerinde iyonlaşan polar bileşikler elektrik iletkenliği sağlayabilir, apolar bileşikler genellikle iletken değildir.
Özetle, bağların polar veya apolar olması, moleküllerin yapısını, davranışını ve uygulama alanlarını derinden etkiler. Bu nedenle, kimyasal analizlerde bağ türünü anlamak kritik öneme sahiptir. |