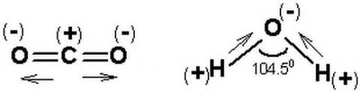F2o molekülü nedir ve nasıl bir yapıya sahiptir?
Oksijen diflorür olarak bilinen F2O bileşiği, flor ve oksijen atomlarının oluşturduğu ilginç bir moleküler yapı sergiler. Renksiz gaz formunda bulunan bu kararsız bileşik, yüksek reaktivitesi ve alışılmadık elektronik özellikleriyle dikkat çeker. Moleküler geometrisi, bağ karakteristikleri ve kimyasal davranışları, inorganik kimya alanında temel prensipleri anlamak açısından önem taşır.
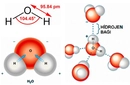
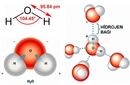
F2O Molekülünün Tanımı ve Genel Özellikleri F2O, kimyasal adıyla oksijen diflorür, oksijen ve flor elementlerinden oluşan bir inorganik bileşiktir. Formülü Oksijen (O) ve iki Flor (F) atomunu içerir, bu nedenle F2O olarak yazılır. Bu bileşik, oda sıcaklığında renksiz bir gaz halinde bulunur ve oldukça kararsız, reaktif bir yapıya sahiptir. Flor, elektronegativitesi en yüksek element olduğundan, F2O molekülünde ilginç elektronik özellikler sergiler. Genellikle yanıcı ve oksitleyici ajan olarak kullanılır, ancak pratik uygulamaları sınırlıdır çünkü zehirli ve patlayıcı olabilir. F2O'nun Moleküler Yapısı ve Bağ Özellikleri F2O molekülü, merkezde bir oksijen atomu ve ona bağlı iki flor atomundan oluşan kıvrımlı (bent veya V-şekilli) bir yapıya sahiptir. Bu yapı, su molekülüne (H2O) benzer, ancak flor atomları hidrojen yerine geçer. Molekülün geometrisi, merkez oksijen atomunun hibridizasyonu ve elektron çifti itmesi nedeniyle belirlenir:
Bu kıvrımlı yapı, molekülün polar olmasına neden olur; oksijen kısmen negatif, flor atomları ise kısmen pozitif yük taşır (florun elektronegatifliği oksijenden daha yüksek olduğundan, bu alışılmadık bir durumdur—genellikle oksijen daha elektronegatiftir, ancak flor istisnadır). F2O'nun Kimyasal Özellikleri ve Kararlılığı F2O, kararsız bir bileşiktir ve kolayca ayrışabilir veya reaksiyona girebilir. Florun yüksek reaktivitesi, F2O'nun güçlü bir oksitleyici ajan olmasını sağlar. Örneğin, suyla temas ettiğinde hızla hidrojen florür (HF) ve oksijene dönüşebilir. Ayrıca, organik bileşiklerle şiddetli reaksiyonlara girerek yanma veya patlamalara neden olabilir. Sentezi genellikle flor gazının sulu çözeltilerle kontrollü reaksiyonlarıyla yapılır, ancak güvenlik önlemleri gerektirir. Kararlılığı, düşük sıcaklıklarda artar; oda sıcaklığında yavaşça bozunur, bu nedenle depolama ve taşıma sırasında dikkatli olunmalıdır. Sonuç F2O veya oksijen diflorür, ilginç bir moleküler yapıya sahip olan, kıvrımlı geometrili ve polar özellikler gösteren bir bileşiktir. Yüksek reaktivitesi ve kararsızlığı nedeniyle, endüstriyel kullanımı sınırlı olsa da, kimya araştırmalarında flor bileşikleri ve oksitleme mekanizmaları üzerine çalışmalarda önem taşır. Genel olarak, F2O'nun yapısı ve özellikleri, periyodik tablodaki elementlerin elektronegativite farklarının moleküler davranışı nasıl etkilediğini anlamak için değerli bir örnek oluşturur. |